리튬이온배터리의 특성 및 발생 가스 분석
글 이준혁 방재시험연구원 융합방재연구센터 선임연구원
1. 머리말
리튬이온배터리는 에너지저장장치(ESS)의 주요 구성품이고 전기자동차 및 휴대폰배터리 등 다양한 용도로 널리 사용되고 있으며, 그 수요는 증가하는 추세이다. 리튬이온배터리는 에너지 이용 효율성 등 다양한 장점이 있으나, 최근 에너지저장장치(ESS) 및 전기 자동차 등에서 화재, 폭발 사고가 지속적으로 발생하고 있어 이슈가 되고 있다.
리튬이온배터리에 기계적 이상조건, 전기적 이상조건 및 열적 이상 조건이 발생하면 열폭주 현상이 발생한다. 열폭주 발생 시 발생에너지가 크기 때문에 이를 제어하기 매우 어려운 실정이다. 이러한 리튬이온배터리의 위험성을 경감 하고자 안전대책 마련을 위한 다양한 연구가 진행되고 있다.
리튬이온배터리의 열폭주 대응을 위한 첫 번째 단계는 열폭주 전에 발생하는 가스를 조기에 감지하는 것이다. 가스 조기 감지를 위해서는 리튬이온배터리의 열폭주 시 어떤 가스가 발생하는지에 대한 파악이 중요하다. 리튬이온배터리에서는 벤트 및 열폭주 발생 시 다양한 가스가 발생되므로 이에 대한 분석이 기본적으로 이루어져야 한다. 여기에서는 리튬이온배터리의 고유한 특성과 발생 가스에 대하여 기술하고자 한다.
2. 리튬이온배터리 특성
가. 구성 요소
리튬이온배터리는 충전 시 리튬 이온을 제공하는 양극(Cathod), 리튬이온을 저장하는 음극(Anode), 양극과 음극에서 발생한 전자가 외부회로를 통할 수 있도록 내부 단락을 방지하는 분리막(Seperator), 리튬이온이 이동할 수 있는 공간과 환경을 제공하는 전해액(Electrolyte) 등으로 구성된다.
(1) 양극 (Cathod)
리튬이온배터리는 리튬의 화학적 반응으로 전기를 생산하는 배터리이며, 리튬이 들어가는 공간이 바로 ‘양극’이다. 하지만 리튬은 원소 상태에서는 반응이 불안정해서 리튬과 산소가 만난 리튬산화물이 양극에 사용된다. 리튬 산화물처럼 양극에서 실제 배터리의 전극 반응에 관여하는 물질을 ‘활물질’이라고 부른다. 즉, 리튬이온 배터리의 양극에서는 리튬산화물이 활물질로 사용되는 것이다.
양극을 조금 더 자세히 살펴보면, 양극의 틀을 잡아주는 얇은 알루미늄 기재에 활물질과 도전재 그리고 바인더가 섞인 합제가 입혀져 있다. 활물질은 리튬이온을 포함하고 있는 물질이고, 도전재는 리튬산화물의 전도성을 높이기 위해서 넣고, 바인더는 알루미늄 기재에 활물질과 도전재가 잘 정착할 수 있도록 도와주는 일종의 접착 역할을 한다.
이렇게 만들어진 양극은 배터리의 특성을 결정짓는 중요한 역할을 하는데, 어떤 양극 활물질을 사용했느냐에 따라 배터리의 용량과 전압이 결정된다. 리튬을 많이 포함했다면 용량이 커지게 되고, 음극과 양극의 전위차가 크면 전압이 커진다. 일반적으로 음극은 종류에 따라 전위의 차이가 작은데 반해 양극은 상대적으로 차이가 크기 때문에 양극이 배터리 전압을 결정짓는 데 중요한 역할을 한다.
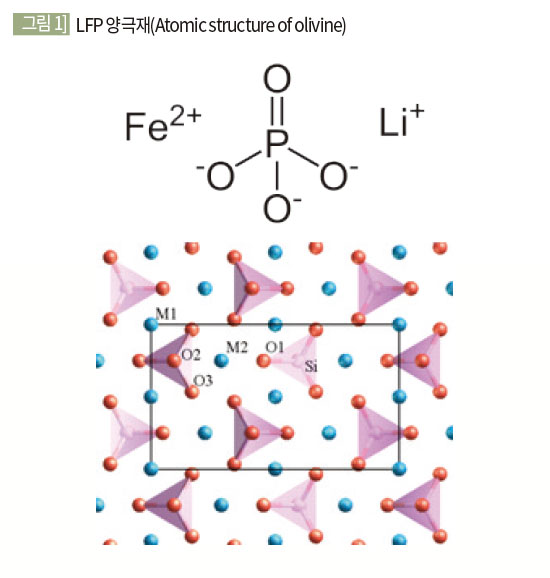
양극재의 열 반응성 순서
LCO > NCA > NCM > LMO > LFP
[그림 1]과 같이 LFP 계열의 양극재는 강력한 P=O 공유결합으로 인해 다른 양극재에 비해 산소 원자의 탈락(열분해로 인한 산소 발생 등)이 어려우며 열 안정성이 뛰어나다.
(2) 음극 (Anode)
음극 역시 양극처럼 음극 기재에 활물질이 입혀진 형태로 이루어져 있다. 음극 활물질은 양극에서 나온 리튬이온을 가역적으로 흡수/방출하면서 외부 회로를 통해 전류를 흐르게 하는 역할을 수행한다.
음극은 구리 기재 위에 활물질, 도전재, 바인더가 입혀지고 음극에는 대부분 안정적인 구조를 지닌 흑연(Graphite)이 사용된다. 흑연은 음극 활물질이 지녀야 할 조건들인 구조적 안정성, 낮은 전자 화학 반응성, 리튬 이온을 많이 저장할 수 있는 조건, 가격 적정성 등을 갖춘 재료로 꼽히고 있다.
(3) 전해액 (Electrolyte)
앞서 양극과 음극을 설명할 때 리튬 이온은 전해액을 통해 이동하고, 전자는 도선을 통해 이동한다고 기술하였다. 이온은 전해액으로 이동하고, 전자는 도선으로 이동하게 하는 것이 배터리에서 전기를 사용할 수 있는 가장 중요한 부분이다. 만약 전자가 도선이 아니라 전해액을 통해 이동하게 되면 전기를 사용할 수 없는 것은 물론이고, 내부 단락으로 인한 열폭주 등 안전성까지 위협받게 된다. 전해액이 바로 그 역할을 수행하는 구성 요소로 양극과 음극 사이에서 리튬 이온을 이동할 수 있도록 하는 매개체인 셈이다. 전해액은 리튬이온을 잘 이동시킬 수 있도록 이온 전도도가 높은 물질이 주로 사용된다.
전해액은 염, 용매, 첨가제로 구성되어 있다. 염은 리튬이온이 지나갈 수 있는 이동 통로, 용매는 염을 용해시키기 위해 사용되는 유기 액체, 첨가제는 특정 목적을 위해 소량으로 첨가되는 물질이다. 이렇게 만들어진 전해액은 이온들만 전극으로 이동시키고, 전자는 통과하지 못하게 한다.
전해액은 리튬 이온 배터리의 혈액으로 간주되고 분리막과 전극의 기공 공간은 전해액으로 채워진다. 충전/방전 과정에서 리튬 이온은 음극/양극에서 탈리되어 전해질을 통해 양극/음극으로 전달된다. 즉, 리튬이온은 전해질에서 자유롭게 흐른다. 따라서 전해질 용매는 빠른 리튬 이온 전달을 보장하고 동시에 우수한 물리·화학적 특성을 가져야 한다.
일반적으로 사용되는 전해액은 에틸렌카보네이트(EC), 디에틸카보네이트(DEC), 프로필렌카보네이트(PC), 에틸메틸카보네이트(EMC) 및 디메틸카보네이트(DMC)와 같은 유기 용제와 다음과 같은 용제에 용해된 염으로 구성된다. DMC, DEC 및 EMC와 같은 선형 탄산염은 유전 상수가 낮고 점도가 낮으며 휘발성이 높다. 이러한 용매에서 리튬 염의 해리가 보장되어야 하며 용매는 높은 유전 상수와 낮은 점도를 가져야 하므로 고리형 탄산염과 선형 탄산염의 혼합물이 종종 사용된다.
(4) 분리막 (Seperator)
양극과 음극이 배터리의 기본 성능을 결정한다면 전해액과 분리막은 배터리의 안전성을 결정짓는 구성요소라고 할 수 있다. 분리막은 양극과 음극이 서로 섞이지 않도록 물리적으로 막아주는 역할을 담당하고 있다. 전자가 전해액을 통해 직접 흐르지 않도록 하고, 내부의 미세한 구멍을 통해 원하는 이온만 이동할 수 있게 만든다. 즉, 물리적인 조건과 전기 화학적인 조건을 모두 충족시킬 수 있어야 한다. 현재 상용화된 분리막으로는 폴리에틸렌(PE), 폴리프로필렌(PP)과 같은 합성수지가 있다.
분리막은 양극과 음극을 분리하는 데 사용되어 내부 단락(ISC, Internal Short Circuit)을 방지하는 동시에 자유 리튬 이온을 전달할 수 있다. 분리막은 전기 화학적 활성 물질은 아니지만 안전성을 보장하기 위한 매우 중요한 구성 요소이다. 분리막이 손상되면 배터리는 ISC로 인해 열 폭주가 발생 될 수 있다. 게다가 분리막은 이온 수송에 중요한 역할을 하며 속도 성능과 셀 수명에 영향을 준다. 기존의 상용 분리막은 폴리에 틸렌(PE) 또는 폴리프로필렌(PP)으로 만든 Polyolefin Membrane이다. 이는 일반적으로 두께가 25μm 미만이고 다공성이 약 40%이다.
분리막의 열 안정성과 기계적 강도를 높이기 위해 세라믹 코팅 및 다층 분리막을 포함하여 많은 새로운디자인이 도입되었다. 세라믹 복합 기반 재료(종종 Al 및 Si의 산화물)는 고분자 Membrane 기판의 한쪽 또는 양면에 코팅되며 세라믹 코팅은 높은 온도에서 수축 정도를 줄여 분리막의 기계적 및 열적 안정성을 향상시킬 수 있다. 다층 분리막은 두 개의 층이 서로 다른 상변화 온도를 갖는 셧다운 기능으로 설계되었다. 예를 들어 Celgard의 PP-PE-PP 구성인 삼층 분리막이 그것이다. PE와 PP의 용융점은 각각 135℃와 165℃이다. 배터리의 온도가 상승하면 저융점 성분인 PE가 먼저 녹고 PP 층의 기공을 채워 이온의 이동을 중지하고 전지의 전류를 차단한다. 전류 흐름이 차단되면 열폭주 위험이 크게 감소한다.
ISC는 약 130℃(PE 분리막의 경우), 170℃(PP 또는 PP/PE/PP 분리막의 경우) 또는 최대 200℃(세라믹 코팅이 있는 분리막의 경우)에서 발생할 수 있다. 210℃ 이상에서도 열 안정성이 우수한 폴리에스테르 섬유매트(부직포와 유사한 재질), 실리카/폴리비닐리덴 플루오라이드(PVDF) 다공성 복합 막을 포함하여 다른 새로운 재료와 디자인이 도입되고 있다.
이렇게 분리막은 양극과 음극이 서로 섞이지 않도록 물리적으로 막아주는 역할뿐만 아니라, 전자가 전해액을 통해 직접 흐르지 않도록 하고, 내부의 미세한구멍을 통해 원하는 이온만 이동할 수 있게 만든다. 분리막이 손상되면 배터리의 내부 단락으로 인하여 열폭주가 발생될 수 있다. 따라서, 분리막은 배터리의 안전성을 결정 짓는 중요한 구성 요소라고 할 수 있다.
(5) SEI (Solid electrolyte interphase)
충전을 하게 되면, 리튬이온이 양극에서 음극으로 이동하면서 전해질 내의 첨가제(additive)와 화학적 부반응을 하게 되어 음극(-) 계면 살짝 앞쪽에 얇은 고체 막이 형성되는데 이것을 SEI(Solid electrolyte interphase)라고 한다. SEI 층의 형성은 배터리 셀을 충전할 때 리튬 이온이 음극으로 이동하는 과정에서, 음극 전해액(Electrolyte in anode) 내의 첨가물과 화학적 부반응을 일으켜, 얇은 고체 막을 만드는 것으로 파악된다. 단, 산화/환원으로 인한 전해액 첨가제와 리튬 이온의 부반응이라는 뜻으로, 무조건 음극(Negative electrode)쪽에만 SEI가 형성된다는 것은 아니다.
SEI라고 하는 보호막은 전해질의 분해 생성물로부터 전극 표면에 형성된다. SEI는 추가 전해질 분해를 방지하고 지속적인 전기화학 반응을 보장하기 위해 Li+ 수송을 허용하고 전자를 차단한다. 이렇게 SEI 층은 Li+ 외 다른 전해질 성분과 전자에 대해서는 투과성이 없기 때문에 고유한 특성을 지닌다고 볼 수 있다.
일반적으로 SEI는 (i) 전해질 화합물을 추가 환원으로부터 보호하고 (ii) 충전된 전극을 부식으로부터 합리적으로 보호한다. 단, HF와 같은 산성 화합물의 형성(예 : LiPF6과 미량의 물과의 반응)은 SEI의 안정성에 부정적인 영향을 미치는 것으로 보고 되었다.
나. 열폭주 (Thermal Runaway)
열폭주 메카니즘은 연쇄 반응으로 해석이 가능하며, 온도가 비정상적으로 상승하면 화학 반응이 순차적으로 일어나는 연쇄 반응을 형성하게 되는데, 이를 일컫는 Heat–Temperature-Reaction(HTR) 루프는 연쇄 반응의 근본 원인이다. 구체적으로, 비정상적인 발열은 리튬이온 배터리의 온도를 상승시키고 SEI 분해와 같은 부반응을 시작한다. 부반응은 더 많은 열을 방출하여 HTR 루프를 형성한다. HTR 루프는 셀이 열폭주를 겪을 때까지 극도로 높은 온도에서 순환된다.
해당 과정에서 SEI 분해, 양극과 전해질의 반응, PE(분리막 재료)의 용융, NCM 음극의 분해, 전해액의 분해 등이 순차적으로 진행된다. 분리막의 세라믹 코팅이 파괴되면 대규모 내부 단락으로 인해 배터리의 전기 에너지가 순간적으로 방출되어 전해액이 연소될 수 있는 열폭주가 발생한다. 배터리의 음극 및 양극재료는 열폭주 시 전해액과 반응하며, 전해액은 열폭주 동안 분해될 수 있다. 전해액 중의 LiPF6 염은 분해반응으로 HF 등을 포함한 물질을 생성하게 된다. 전해액의 양은 열폭주 동안 배터리의 열 생성에 영향을 줄수 있으며, 이는 가스 발생과도 직결된 문제로 생각된다. Dahn 등은 LMO/전해액의 경우, 전해액이 추가될수록 발열 또한 증가한다는 것을 발견했다.
단, 현재는 이러한 재료의 분석으로만 열폭주 거동을 예측할 수 없어 해당 기술의 개발이 시급한 상태이다. 관련 연구 및 기술 개발은 배터리 설계의 안전성 향상에 매우 중요한 요소로 작용 될 것이다.
다. 이상조건
열폭주를 발생시키기 위하여 리튬이온배터리에 인위적으로 가할 수 있는 대표적인 이상 조건으로는 과충전, 가열 등이 있다.
과충전은 통상 배터리에 일정 전류를 지속적으로 인가하는 방식으로 수행된다. State of Charge(SOC) 130% 초과 시 용량 손실이 크고 이는 배터리 수명에 직결될 수 있으며, SOC 140%가 초과될 경우에는 열폭주가 발생 될 수 있다. 양극에 NCM + LMO, 음극에 Graphite를 사용하는 리튬이온배터리의 과충전 시 Peak 전압은 약 5.4 V 가량으로 확인되며, 해당 전압초과 시 열폭주가 유발되었다.
가열 방식으로는 배터리 1면 전체를 가열하는 열판가열 방식, 필름 히터 등을 사용하여 일부분만 가열하는 국부가열 방식 등이 있으며, 열원은 외부 또는 내부에서 가할 수 있으나 외부에서 열판 등을 이용하여 가열하는 것이 일반적이다.
3. 발생 가스에 대한 조사
가. 가스 발생 원리
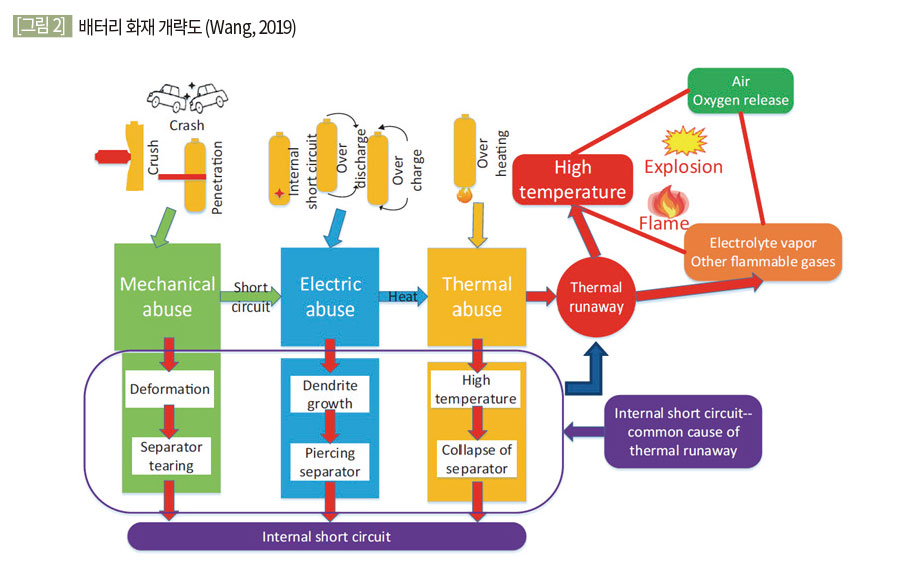
발생 가스의 양, 종류 및 비율에 관여되는 요소들은 SOC, 화재 발생원인, 용량 등 다양하지만 크게 다음과 같은 순서를 따른다. 일단 화재를 발생시키는 외부요인에 의해 배터리 내부의 SEI, 전해액 등이 분해되며 가스가 생성된다. 배터리 내부에서는 계속 가스가 생성되어 압력이 증가하게 된다. 증가한 압력으로 인하여 배터리 내부에 설치된 안전장치가 작동하여 1차 분출(1st venting)이 일어나게 된다. 이후 계속된 외부 요인으로 인하여 내부의 분리막이 분해되어 내부 단락이 일어나게 된다. 이때 열폭주가 발생하며 내부 스파크 등 다양한 원인에 의해 연소가스가 점화되어 화염과 함께 2차 분출 (2nd venting)이 발생한다. [그림 2]는 배터리 화재가 발생하는 원인을 설명하기 위한 개략도이다.
나. 화재 원인
배터리 화재는 크게 외부 가열에 의한 과열과 과충전 두 가지 원인에 의해 발생하며 원인에 따라 가스 발생에 차이가 존재한다.
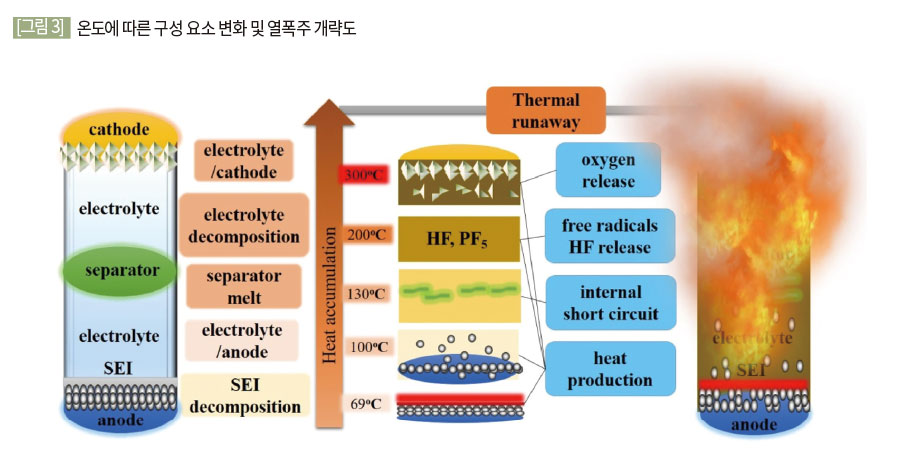
(1) 과열 (Thermal Abuse)
기상 조건, ESS 시스템 내부 냉각장치 오작동 등 다양한 원인에 의해 배터리 외부 열원에 의해 배터리의 온도가 증가하게 된다. 온도가 일정 이상으로 가열될 경우 배터리 내부 온도가 증가 되며 전해액과 분리막(SEI)이 분해 온도 이상일 경우 분해되며 가스가 생성된다.
생성된 가스들로 인해 내부 압력이 증가하면 Safety cap에 의해 1차 분출이 일어난다. 이후 내부온도가 분리막의 녹는점 이상이 되면 내부 단락이 일어나며 열폭주가 발생하여 화염과 함께 2차 분출이 일어난다. 이때 SOC가 낮을 경우 열폭주가 발생하지 않고 1차 분출만이 발생하는 경우도 존재한다.
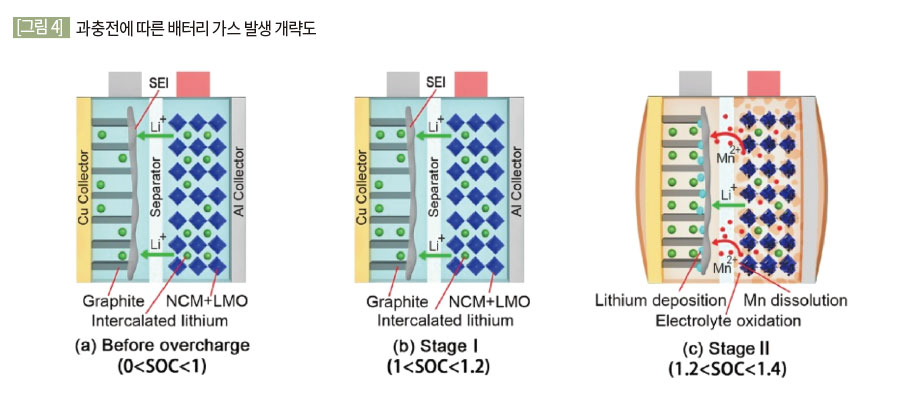
(2) 과충전 (Overcharge)
[그림 3]은 배터리 과충전에 의한 가스 발생 개략도이다. 배터리 과충전 시 가용한 리튬 이온이 부족해지면서 내부 전해액이 분해되며 가스가 생성된다. 이 가스들로 인하여 배터리 내부 압력이 증가하며 1차 분출로 이어지게 된다. 이후 계속 압력이 증가하다 내부 단락이 일어나며 열폭주가 일어나며 2차 분출이 일어난다. (Essl 2020)
다. HF 생성
HF는 배터리 화재 시 발생되는 대표적인 독성가스로 인체에 매우 치명적이기 때문에 중요하게 다루어진다. Larsson 등 일련의 실험에 의하면 HF의 경우 다른 가스들과는 생성 메커니즘에 차이가 있다. 다른 가스들의 경우 SOC가 클수록 생성량이 증가했지만 HF 가스의 경우는 다른 것으로 조사되었다. Lecocq(2016)의 연구에 의하면 SOC가 0%일 때 HF분출량 및 분출 지속시간이 SOC 100%인 경우보다 더 크다.
이러한 결과는(Larsson, 2017)의 연구에서도 조사되었다. SOC 50%, 0%에서의 HF 생성량이 100%에서의 생성량보다 더 많고 더욱 오래 분출되는 경향을 확인할 수 있다. 이는 HF 가스의 생성 메커니즘이 다른 가스들과는 다르기 때문이다.
라. 주요 발생 가스
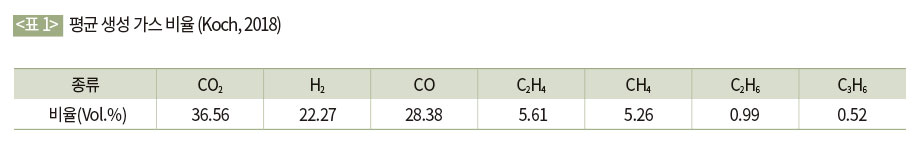
Koch (2018)는 CO2, CO, H2, C2H4, CH4, C2H6, C3H6(이산화탄소, 일산화탄소, 수소, 에틸렌, 메탄, 에탄, 프로펜)의 7가지 가스가 배터리 화재 시 발생하는 주요한 생성 가스라고 밝혔다. 이 외에도 HF, POF3 등의 가스 또한 생성된다. Wang 등은 발생 가스의 종류 중 CO2, CO, H2의 비중이 가장 높다고 밝혔다. 본 실험연구에서 발생된 가스는 Koch, Wang이 밝힌 가스를 포함하고 있으며, CO2의 비율이 가장 높았다.
마. 가스 비율
(1) 외부 수열 시 발생 가스 비율
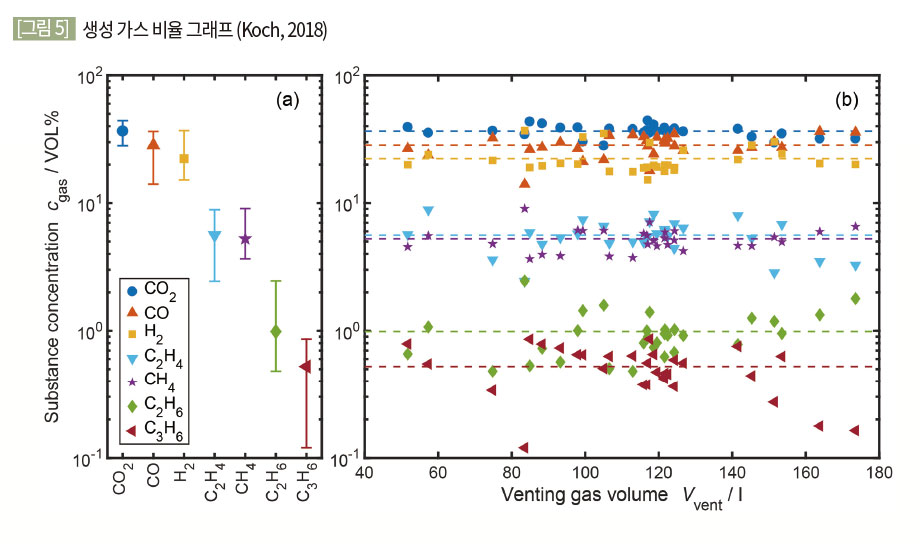
가스 생성 비율은 배터리의 특성에 따라 그 값이 다르나 대체적으로 다음과 같다. 생성 가스 중 대부분의 비율을 차지하는 가스는 CO2, H2, CO이며 그 비율은 대략 부피 비 85%이며 나머지 15%의 경우 C2H4, CH4, C2H6, C3H6와 같은 탄화수소들로 이루어져 있다. <표 1> 및 [그림 4]는 Koch의 실험연구 결과이다.
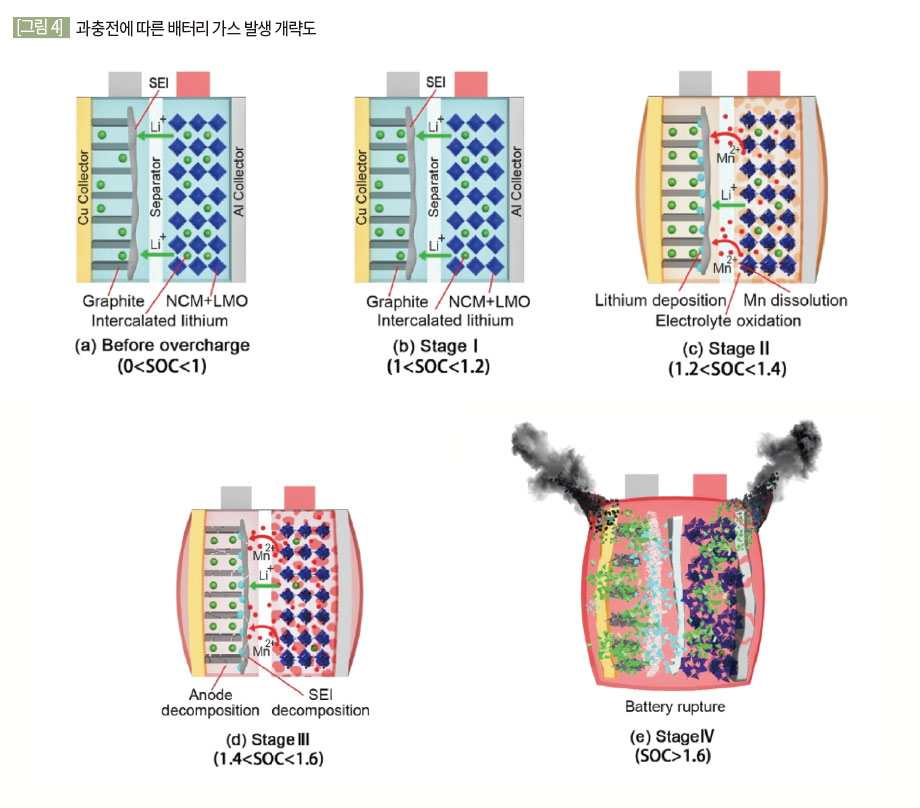
(2) 과충전 시 발생 가스 종류 및 비율
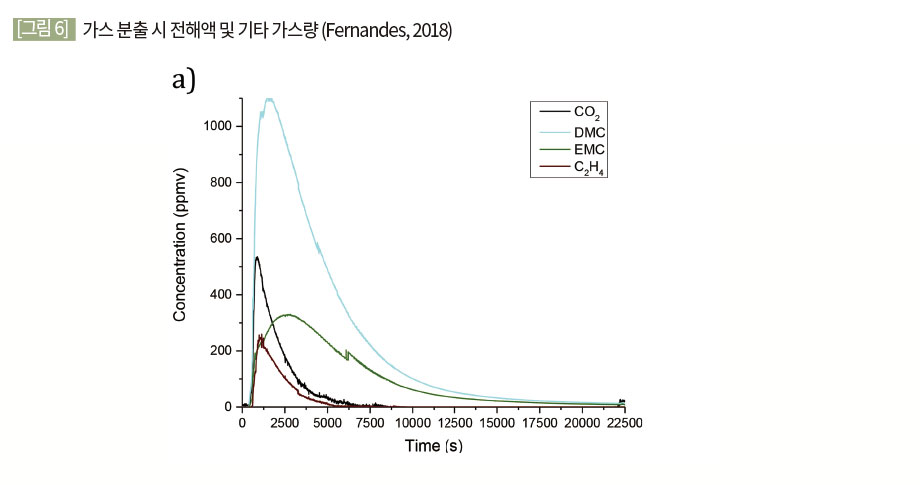
과충전 시 1차 분출 가스의 종류는 외부 수열에 의한 배터리 화재 연구 결과들과는 사뭇 다른 양상을 보인다. Fernandes 등(2018)에 의하면 과충전에 실험의 경우 2차 분출 시에는 외부 수열과 비슷한 결과 값을 갖지만 1차분출의 경우 DMC, EMC와 같은 전해액 증기가 주요 성분 중 하나라 제안하였다.
(3) 발생 가스량
생성되는 가스의 양은 보통 SOC와 용량과 관련이 있다. [그림 6]은 20Wh 이하의 배터리 화재 시 발생 연소가스의 양과 SOC와의 상관관계를 비교한 그래프이다. [그림 6]에서 알 수 있듯이 SOC가 증가하면 발생 가스량도 증가함을 알 수 있다.
4. 맺음말
문헌 조사 및 실험연구 분석 결과, 리튬이온배터리 화재 시 발생 되는 가스 중에 CO2와 CO가 가장 많은 비중을 차지하는 것을 파악할 수 있었다. 연기 감지기와 CO 계열 감지 센서를 통해 초기에 ESS 화재를 감지하고 특히 CO2 유동에 대한 다양한 시험을 통하여 보다 안정적인 화재 감지 시스템을 구축하여야 할 것이다.
참고문헌
② S. Koch, A. Fill, K. P. Birke, “Comprehensive gas analysis on large scale automotive lithium-ion cells in thermal runaway”, Journal of Power Sources, Volume 398, 15 (2018) Pages 106-112
③ F. Larsson, P. Andersson, P. Blomqvist & B. E. Mellander, “Toxic fluoride gas emissions from lithium-ion battery fires”, Scientific reports, 7(1) (2017) Pages 1-13
④ Y. Fernandes, A. Bry & S. De Persis, “Identification and quantification of gases emitted during abuse tests by overcharge of a commercial Li-ion battery”, Journal of Power Sources, Volume 389 (2018) Pages 106-119
⑤ A. Lecocq, G. G. Eshetu, S. Grugeon, N. Martin, S. Laruelle & G. Marlair, “Scenario-based prediction of Li-ion batteries fire-inducedtoxicity”, Journal of Power Sources, Volume 316 (2016) Pages 197-206